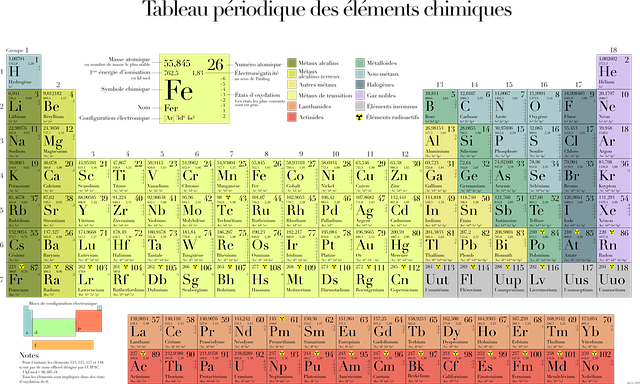
Periodickou tabulku prvků zná každý z nás. Setkali jsme se s nà již na základnà škole, mnozà z nás potom i v dalÅ¡Ãm studiu Äi v zamÄ›stnánÃ. Bylo nám Å™eÄeno, že v nà najdeme atomy, ze kterých se skládá náš svÄ›t. To vyvolává pÅ™edstavu, že vÅ¡echny prvky, se kterými se zde setkáme, najdeme v pÅ™ÃrodÄ›, byÅ¥ jen ve stopovém množstvÃ.
Â
Â
To vÅ¡ak nenà až tak úplnÄ› pravda. Ve skuteÄnosti se z necelých 150 prvků, které onu tabulku tvoÅ™Ã, jich volnÄ› najdeme pouze 92, pÅ™iÄemž tÃm poslednÃm je Uran. Je pravdÄ›podobné, že v minulosti se jich vyskytovalo vÃce, avÅ¡ak ty jsou nestabilnà s kratÅ¡Ãm poloÄasem rozpadu. To zkrátka znamená, že se postupem Äasu pÅ™emÄ›nily na jiné, stabilnÄ›jÅ¡Ã prvky.
Â
Je pravdou, že ani uran nenà zrovna stabilnà a také procházà onÃm procesem pÅ™emÄ›ny. To je ostatnÄ› také důvod, proÄ je radioaktivnÃ. Pouze jeho poloÄas rozpadu je mnohem delÅ¡Ã, a tak jej jeÅ¡tÄ› můžeme nalézt, a samozÅ™ejmÄ› také využÃt.
Â
Â
Otázkou samozÅ™ejmÄ› je, jak tedy o ostatnÃch prvcÃch vÃme, když se pÅ™irozenÄ› nevyskytujÃ. OdpovÄ›Ä znÃ, že byly vytvoÅ™eny v laboratoÅ™Ãch. Dnes již máme urychlovaÄe Äástic, které nám umožňujà takto objevovat a popisovat nové prvky.
Â
Problém je s tÃm, že jsou velmi nestabilnà a velmi brzy se rozpadnou a pÅ™emÄ›nà na nÄ›který z prvků s nižšÃm atomovým ÄÃslem a vyÅ¡Å¡Ã stabilitou. I proto také majà své využità pouze ve velmi specializovaných pÅ™Ãpadech, hlavnÄ› pak v petrochemickém průmyslu a nÄ›kdy také v lékaÅ™stvÃ.
Â
Je tedy jasné, že bychom periodickou tabulku nemÄ›li brát jako nÄ›co, co je naprosto nemÄ›nné. Nové prvky jsou vytvářeny dennÄ›, zatÃmco o tÄ›ch stávajÃcÃch jsou objevovány nové poznatky. DÃky tomu je i tato tabulka neustále upravována. Za deset let pak může vypadat úplnÄ› jinak, než jak ji známe dnes. Kdo vÃ, co vÅ¡e bude za tu dobu objeveno, a nejen v chemii. Nezbývá nám, než Äekat a uvidÄ›t, kam nás nové objevy zavedou.